Leber’s遗传性视神经病变(Leber’s hereditary optic neuropathy, LHON)是一种最常见的母系遗传疾病(女传男不传),通常表现为双眼无痛性的急性视力下降,尤其18-20岁的男性青年好发。LHON由遗传因素、环境因素或两者共同作用所致,其中线粒体DNA突变是Leber遗传性视神经病变的主要分子发病基础,但目前其分子致病机制尚未完全明确。1988年美国教授Wallace首次发现,LHON主要是由m.11778G>A、m.14484T>C、m.3460 G>A三个线粒体基因突变引发能量代谢不足所致。不同人群的外显率以及男性高发等特点提示X连锁的核修饰基因在LHON的致病机制中起着决定性作用,然而这类基因30年来一直未被鉴定,是公认的线粒体疾病研究中的难题。
浙江大学遗传学研究所管敏鑫教授团队经过八年努力,首次发现了X连锁核修饰基因PRICKLE3突变与线粒体基因突变协同作用引发LHON,破解了LHON男性好发这一30年未解之谜。这是线粒体疾病LHON致病机制研究的一次里程碑式的突破。国际权威期刊《临床研究杂志》在线发表了团队关于X连锁核修饰基因突变引发Leber’s遗传性视神经病变(LHON)的最新研究成果。相关研究曾获得浙江省自然科学基金重点项目支持。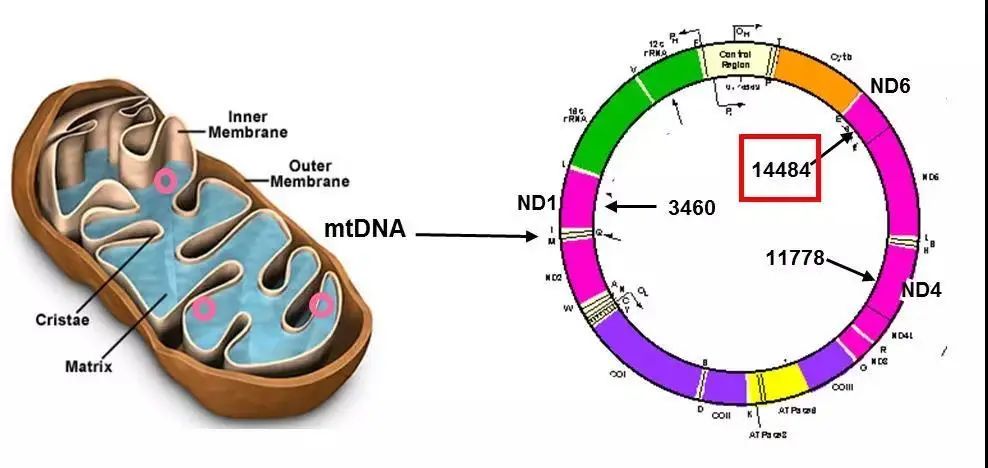
在此项研究中,管敏鑫教授团队对200多个汉族LHON家系进行了系统性大规模的基因筛查,通过外显子测序技术以及生物信息分析和功能验证发现了X连锁基因PRICKLE3。通过对患者源细胞系以及基因敲低的Hela细胞系中进行的系列功能分析,发现了PRICKLE3突变影响了线粒体ATP合酶的组装、稳定性和功能从而导致能量代谢异常。PRICKLE3突变和线粒体基因11778G>A突变协同作用,加重了线粒体能量代谢障碍,从而导致疾病发生。此外,PRICKLE3基因敲除的小鼠呈现出视神经节细胞萎缩、眼底血管异常等LHON病人典型的临床表型。此项研究揭示了线粒体突变和X连锁核修饰基因突变之间的协同作用导致LHON的致病机制,破解了男性好发的未解之谜,这是遗传性眼病致病机制研究的重大突破,为LHON的精准诊断、干预和治疗提供了理论依据和技术支撑,也对其他母系遗传眼病和其他疾病的精准干预治疗具有借鉴意义。